MODELOS ATÓMICOS
A lo largo de la historia se han formulado muchos modelos atómicos:
- S.IV-III
a.C--- Demócrito :propuso la idea del Átomo
- S.III
a.C--- Aristóteles: debatió esa idea y dijo que no podía ser por lo que al
ser el más influyente se le creyó
- S. XIX---1808-- Dalton :fue quien retomo la idea del átomo con su modelo que consistía en una bola maciza: Este modelo explicaba porque las substancias se combinaban químicamente entre sí sólo en ciertas proporciones pero a su vez no podía explicar la electricidad
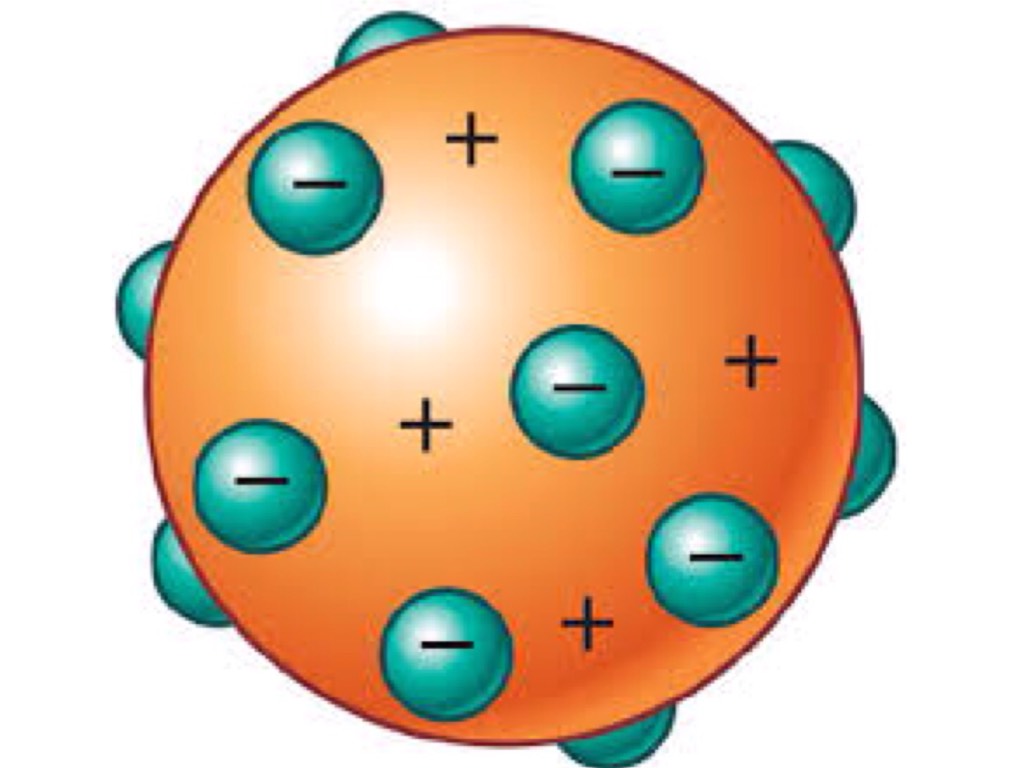
·S.XIX---1897—Thomson :descubrió el electrón y lo introdujo en el modelo de Dalton incrustándolos en aquella bola maziza (modelo del pastel de pasas). Este modelo explicaba los hechos de los rayos catódicos pero sin embargo el modelo de Thomson había dejado de explicar la regularidad de la tabla periódica de Mendeleiev
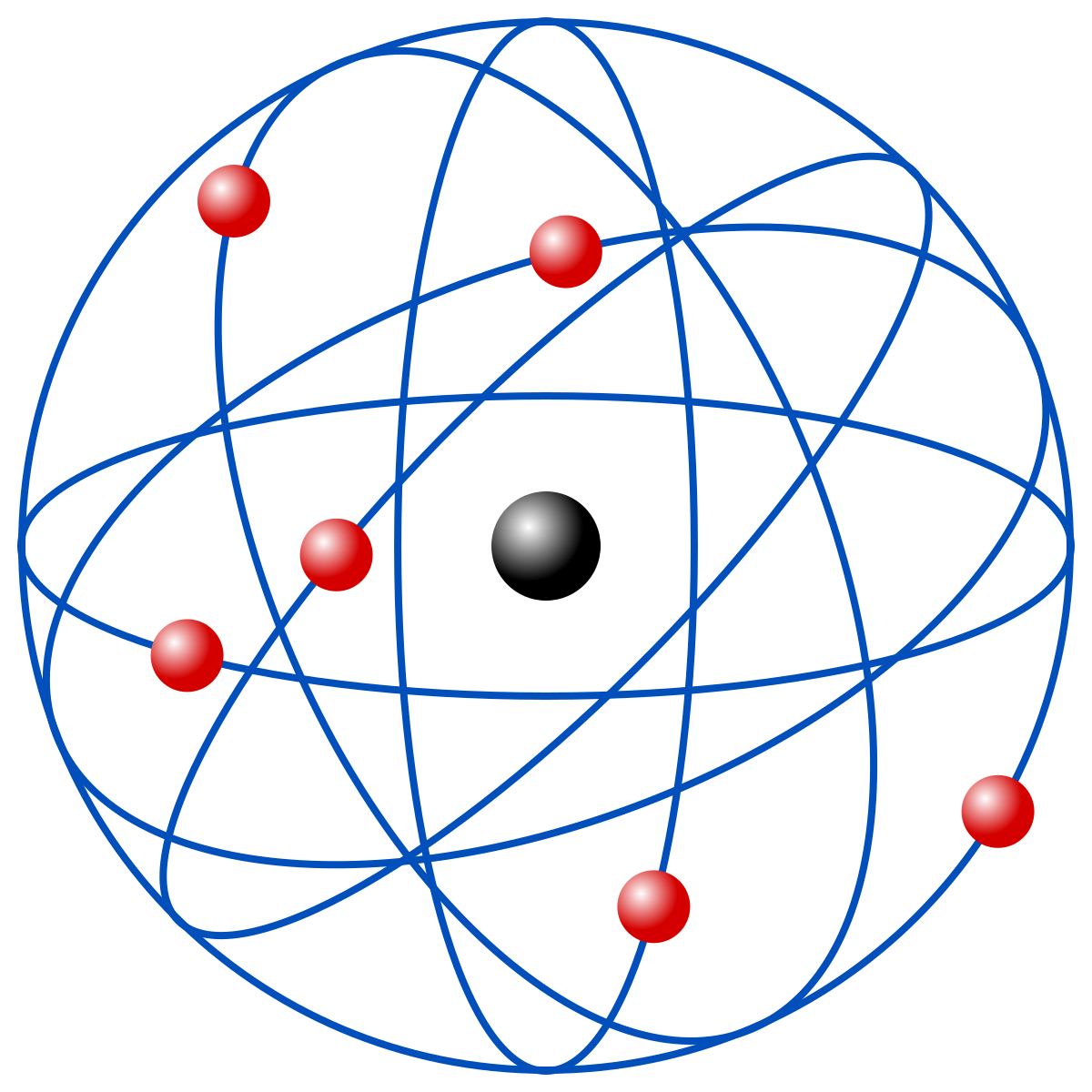
- S.XX---1911—Rutherford: por medio de un experimento que consistía en bombardear una lamina de oro con partículas alfa descubrió que los electrones no estaban incrustados en el núcleo si no que orbitan alrededor de un núcleo formado por protones y neutrones, a este modelo se le llamo modelo nuclear. Pero este tenía un fallo y era que si el electro giraba y giraba al final perdería energía y colapsaría con el núcleo por lo que el átomo se destruiría
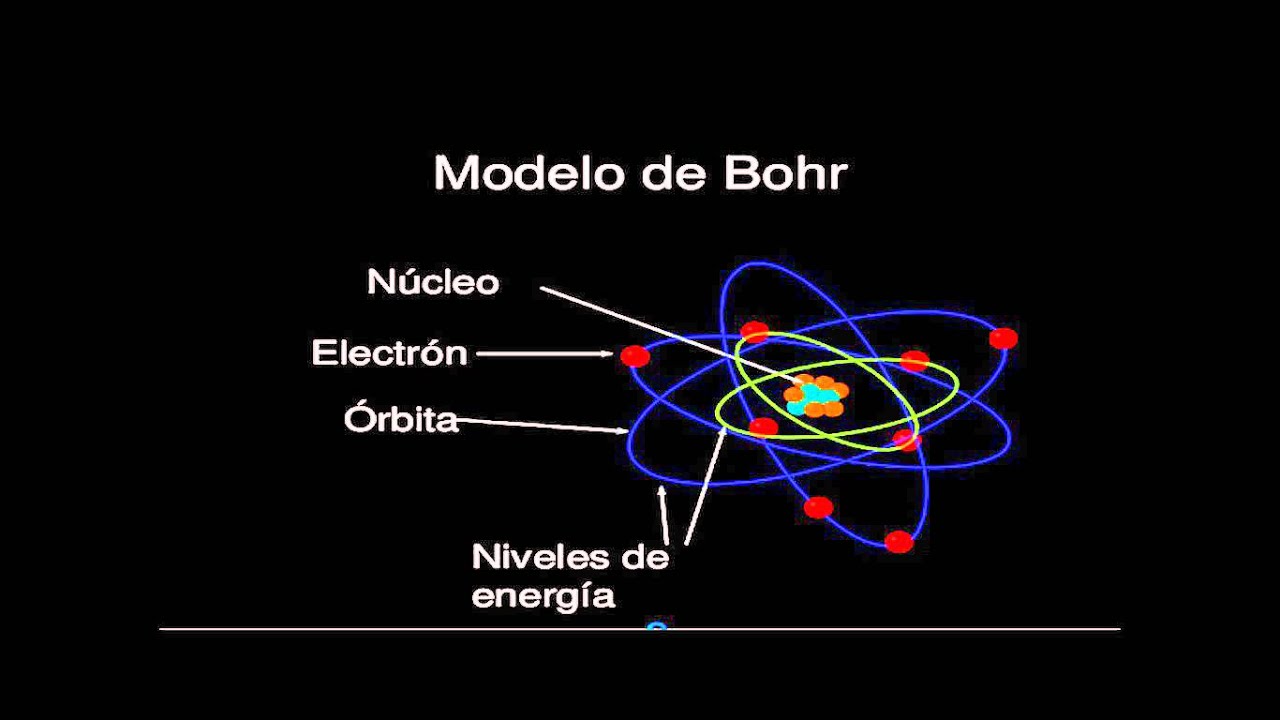
· S.XX---1913—Bohr: poco después introdujo al modelo de Rutherford las orbitas en las cuales en la primero podían haber 2 electrones, en la segunda 8, en la tercera 18 y en la cuarta 32. Este modelo consiguió explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Pero no podia explicar los numeros cuanticos azimutal (l), magnetico (m) y el de spín (s) que propondrían Schrodinger y Heisenberg después
S.XX---1926—Schrodinger y Heisenberg :propusieron el modelo cuántico actual que solucionaba el problema de la perdida de energía de los modelos de Bohr y Rutherford y se valía de la física cuántica para explicarlo. Este situó a los electrones en orbitales en vez de orbitas que delimitaban las zonas de probabilidad en las que un electron podía encontrarse.



No hay comentarios:
Publicar un comentario